Углеводородная скрепка помогла противораковой молекуле запустить самоубийство клеток
Американские исследователи создали новую молекулу, которая запускает в раковых клетках запрограммированное клеточное самоубийство — апоптоз.
Американские исследователи создали новую молекулу, которая запускает в раковых клетках запрограммированное клеточное самоубийство — апоптоз. Молекула принадлежит к классу синтетических пептидов, а ее селективное связывание с мишенью, стабильность и проникновение в клетки обеспечивается за счет специальной алкеновой скрепки, которая соединяет аминокислоты внутри пептида. Детали работы опубликованы в Proceedings of the National Academy of Sciences.
Злокачественная трансформация клеток во многих случаях происходит в результате нарушения программы клеточного самоубийства — апоптоза. Клетки с потенциально опасными мутациями вместо того, чтобы уничтожиться, начинают активно размножаться, что приводит к развитию опухолей. В частности, подавление апоптоза происходит при увеличении количества противоапоптозных белков, которые связываются с компонентами, запускающими программу самоубийства, и блокируют их действие. Повышенная активность противоапоптозного белка Mcl-1, к примеру, зарегистрирована при различных видах лейкемий, лимфом, рака груди, поджелудочной железы, раке шейки матки и немелкоклеточной карциноме легкого.
В ряде экспериментов на мышах было показано, что избирательное подавление активности Mcl-1 в клетках приводит к уменьшению размера опухолей и увеличивает продолжительность жизни животных. Таким образом, Mcl-1 является перспективной терапевтической мишенью в лечении сразу многих видов рака.
Малые молекулы, подавляющие активность Mcl-1, уже существуют и даже проходят клинические испытания, но одними из самых многообещающих препаратов являются синтетические пептиды — короткие аминокислотные цепочки, которые селективно связываются с гидрофобной бороздкой в структуре мишени и имитируют тем самым активность внутриклеточных регуляторных белков.
![Углеводородная скрепка помогла противораковой молекуле запустить самоубийство клеток [1]](/frontend/web/src/img_btx/8c798a2f0376af1d8e12ddcb734b2616.png)
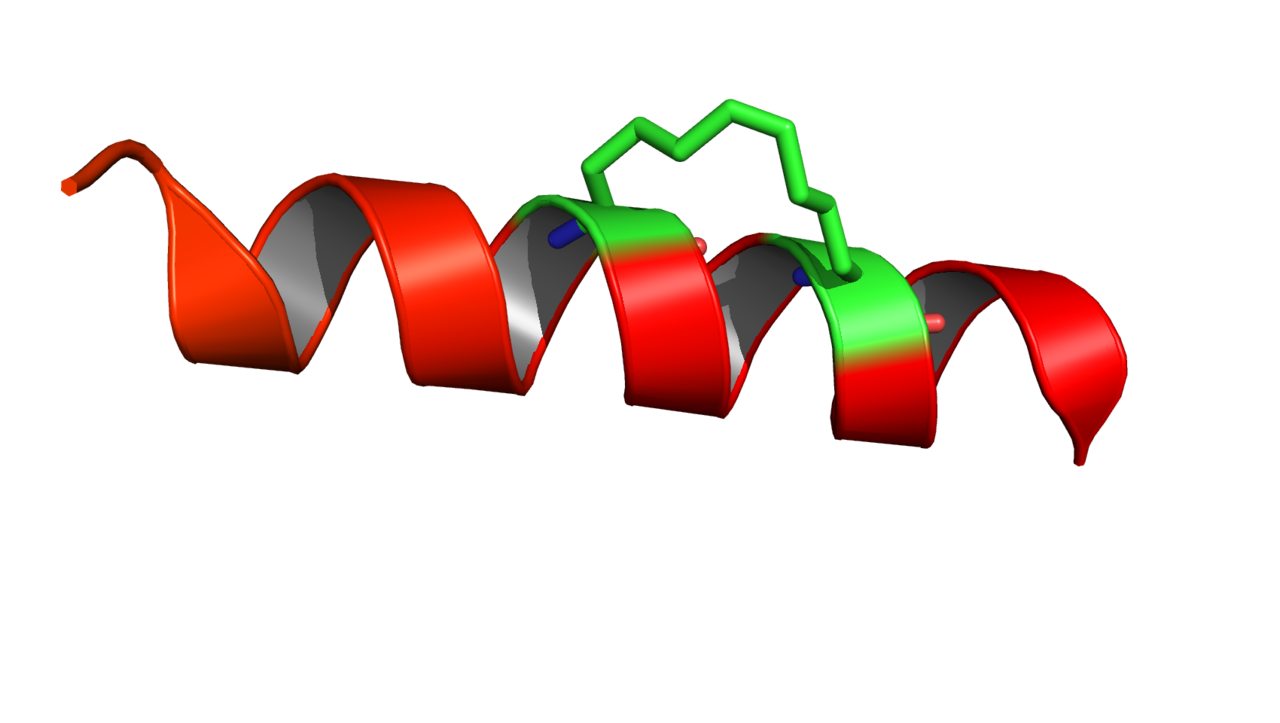
α-спираль, стабилизированная алкеновой скрепкой
Wikimedia Commons
Несмотря на свою селективность и высокую активность, у пептидных препаратов есть серьезные недостатки. В частности, такие молекулы плохо проникают в клетки, и у них нестабильная конформация. Чтобы решить эти проблемы, исследователи из Массачусетского технологического института (США) применили к пептидному ингибитору MS1, имитирующему проапоптозный регуляторный белок Bim, своеобразный «химический степлер».
Ученые показали, что углеводородная алкеновая сшивка между аминокислотами внутри пептида длиной около 20 аминокислот стабилизирует его спиральную конформацию и защищает от расщепления протеазами. Исследователи синтезировали целую панель стабилизированных пептидов и выбрали из них те, что лучше связываются с Mcl-1 и хорошо проникают в клетки. По итогам экспериментов для дальнейшего исследования были выбраны пептиды под названиями SAH-MS1-14 и SAH-MS1-18.
![Углеводородная скрепка помогла противораковой молекуле запустить самоубийство клеток [2]](/frontend/web/src/img_btx/c2498d5a1748997ea066792dbcd2d3ac.png)
SAH-MS1-18 (розовым) взаимодействует с Mcl-1. Синим цветом отмечена скрепка в составе молекулы
Raheleh Rezaei Araghi et al / PNAS 2018
В тесте на цитотоксичность оказалось, что оба вещества вызывают запуск каспазного проаптотического пути в опухолевых линиях, зависимых от Mcl-1, но не действуют на клетки контрольной клеточной линии, в которой активность Mcl-1 не была увеличена. Таким образом, исследователи подтвердили, что MS1 превратился в Mcl-1-специфичный активатор апоптоза, пригодный для перехода к следующей стадии испытаний на животных.
Введением стабилизированных пептидов в терапевтическую практику, в частности, занимается компания Aileron Therapeutics. Эта компанияпровела первые клинические испытания ингибитора такого типа на людях в 2013 году, а в прошлом году ее противораковый препарат, приводящий к активации в клетках белка p53, прошел первую фазу клинических испытаний на пациентах с лимфомой.
Дарья Спасская
Источник: https://nplus1.ru/

